by Kevin Blake,PhD |@kevinsblake

2024年诺贝尔化学奖得主名单。来源: Twitter
瑞典皇家科学院宣布,2024年诺贝尔化学奖分别授予三位得主。一半授予华盛顿大学的大卫·贝克,“以表彰他在计算蛋白质设计方面的贡献”;另一半则由谷歌DeepMind的_德米斯·哈萨比斯_和_约翰·詹普尔_共同获得,“以表彰他们在蛋白质结构预测方面的贡献”。
在这里,我将从实际原因和个人原因两个方面专注于贝克尔的工作。2020年,当哈萨比斯和贾姆珀宣布他们的AlphaFold2时,它得到了媒体大量的正面报道。相比之下,贝克尔2003年设计的新蛋白质工作——该工作被瑞典皇家科学院在宣布奖项时提及——肯定不太为人所熟知。
其次,Baker 是 我博士论文导师的 博士论文导师(因此 Baker 是我的学术“祖父”),同时我的导师也是那篇 2003 年论文的共同第一作者。所以这次发文不仅是因为对生物信息学的一般喜爱,也是出于伪家族荣誉感的驱使。
蛋白质是什么?今年诺贝尔化学奖的主题是利用计算技术分析蛋白质。贝克因此获得了奖金的一半,因为他设计出了定制设计的蛋白质,这些蛋白质具有新颖的形状和功能。
蛋白质是复杂的分子机器,它们在生物体中扮演着多重角色。血红蛋白是一种负责携带氧气的蛋白质,α-淀粉酶负责分解大型多糖,胶原蛋白负责构建结缔组织,胰岛素负责调节新陈代谢,钙泵负责将离子移出细胞——蛋白质具有各种形状、大小和功能。从人类到大肠杆菌,所有生物的生存都依靠蛋白质的活动。
虽然它们的形状和大小各不相同,但所有蛋白质本质上都是由氨基酸链连接而成的长链,然后折叠成三维形状。这就像把绳子打成一个非常复杂的结,但要复杂得多。或者,正如在xkcd漫画中描述的,就像折叠一张纸来制作一个真正活着的鹤一样。

蛋白质折叠问题,了解一下。来源
一共有20种氨基酸,每种都有一个氨基、一个羧基和一个独特的侧链。氨基酸通过一个氨基酸的氨基与另一个氨基酸的羧基形成肽键而连接在一起。这种连接的氨基酸序列被称为蛋白质主链。侧链从主链向外延伸,它们的不同化学结构赋予每种氨基酸不同的性质。有些疏水,不喜欢与水接触;有些亲水,喜欢与水接触。有些带正电,能与带负电的氨基酸相互吸引,反之亦然。
由于这些多种多样的相互作用,氨基酸链不会长时间保持直线状态。链中带正电的氨基酸希望靠近带负电的氨基酸;疏水性氨基酸希望躲开周围的水分子,而亲水性氨基酸则更愿意暴露在水外面。氢键、离子对、范德华力、水介导的疏水相互作用,所有这些力都会促使链弯曲并折叠自身。折叠会形成螺旋和片层,这些螺旋和片层又紧密地与其他螺旋和片层结合在一起。最终,这个混乱的状态会稳定成一种形状,这种形状能最好地平衡所有相互作用的原子间力。这种最低能量状态就是蛋白质的结构形态。
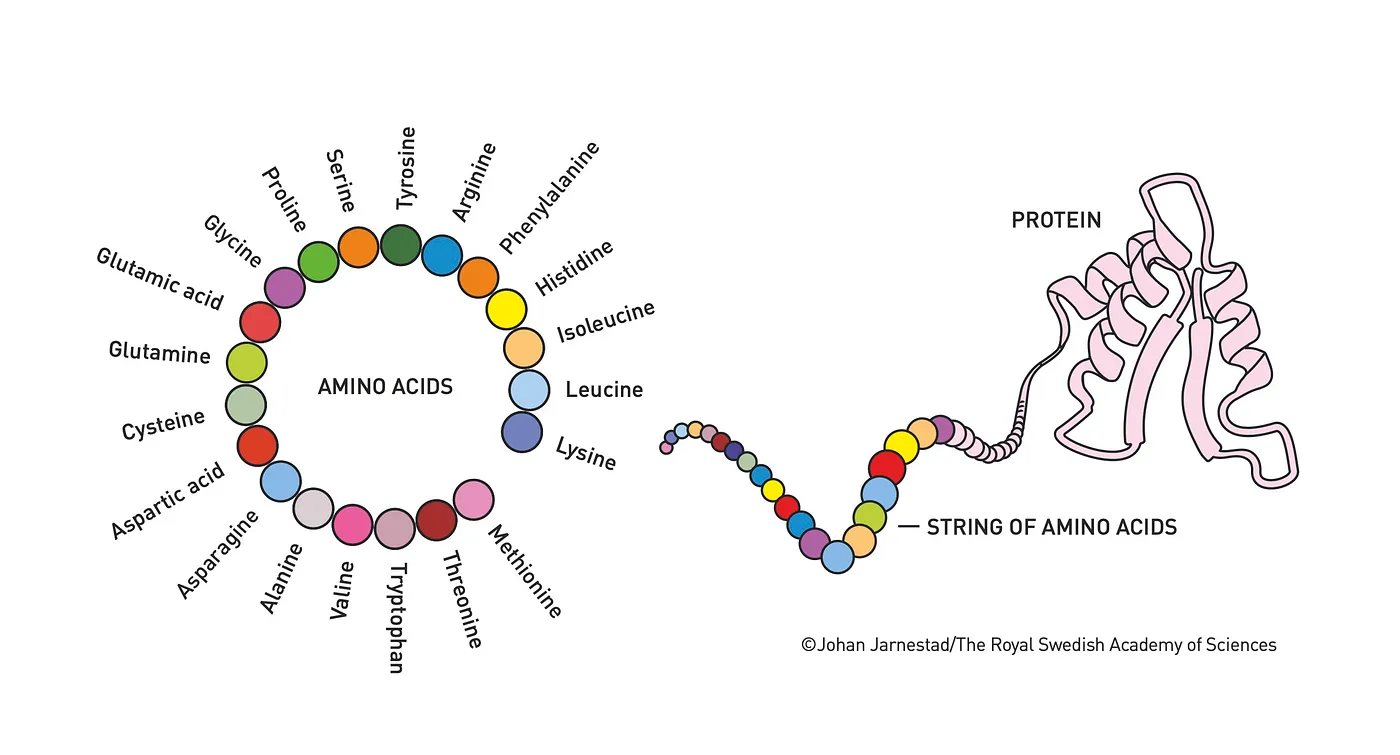
蛋白质是由氨基酸组成的链,折叠成特定的形状。^1
蛋白质设计从零开始“序列-结构-功能范式”认为,蛋白质的功能由其结构决定,而其结构又由其氨基酸序列决定。因此,从头到尾,我们可以通过设计能以可预测方式折叠的氨基酸序列来从头定制蛋白质。贝克因此解决了如何做到这一点的问题而获得了诺贝尔奖。
挑战在于找到一个能够平衡各种氨基酸相互作用的氨基酸序列,从而形成所需的结构。假设任何20种氨基酸的组合都是等可能的,那么对于一个包含100个氨基酸的序列,有20¹⁰⁰(= 1.3 × 10¹³⁰)可能的序列。事实上,找到一个能够折叠的序列就已经是成功了一半,更不用说找到一个能够折叠成你想要的结构的序列了。在理论上可能的序列中,只有非常有限的一部分存在于自然界中,而几乎所有的随机生成的蛋白质序列都无法成功折叠。
几十年前在AlphaFold2之前,Baker开发了Rosetta算法来解决“从头开始”(ab initio)的蛋白质结构预测问题。Rosetta输入一个氨基酸序列,并根据我们所知的氨基酸相互作用的物理原理,通过寻找序列的最低能量构象来构建蛋白质的三维模型。(自其源代码公开以来,Rosetta发展成为一个用于计算建模和分析蛋白质结构的算法套件,包括多种工具和方法。)
蛋白质设计的关键在于意识到Rosetta可以反向运行,也就是说,从计算机生成的结构到能够折叠成该形状的序列。2003年发表在《科学》杂志上的一篇论文中,贝克和他的团队使用这种方法创造出了Top7,这种蛋白质由93个氨基酸组成,其结构在自然界中从未被观察到过。
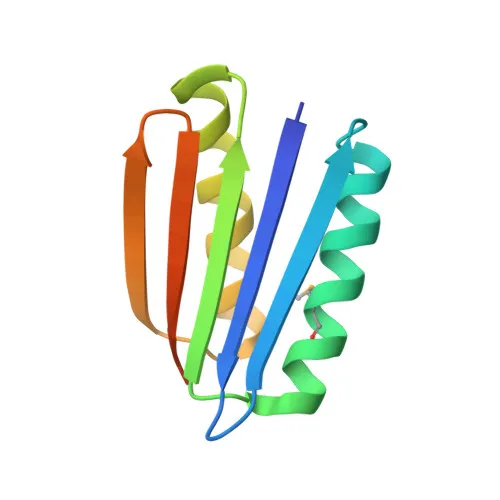
Top7的晶体结构。[来源]( https://www.rcsb.org/structure/1qys)
首先,他们绘制了蛋白质的二维拓扑结构草图,规定了α-螺旋、β-折叠和连接环的长度、排列和顺序,同时确保其不会超出物理能力范围。其次,从已知蛋白质结构片段中组装与蓝图相配合的蛋白质骨架。最后,通过随机改变个别氨基酸的方向或替换为新的氨基酸来优化序列,并找到能量最低的状态构型。
最终结果是一种序列无关的新蛋白质结构,据所有 in silico 测量,它在现实中可能会折叠。但是它实际上能在现实生活中折叠吗?为了测试这一点,他们进行了以下实验:将合成基因插入到 E. coli 中,收获细胞并纯化蛋白质,确定其X射线晶体结构。这表明,不仅它能够折叠,其结构几乎与他们想要构建的结构完全一致。
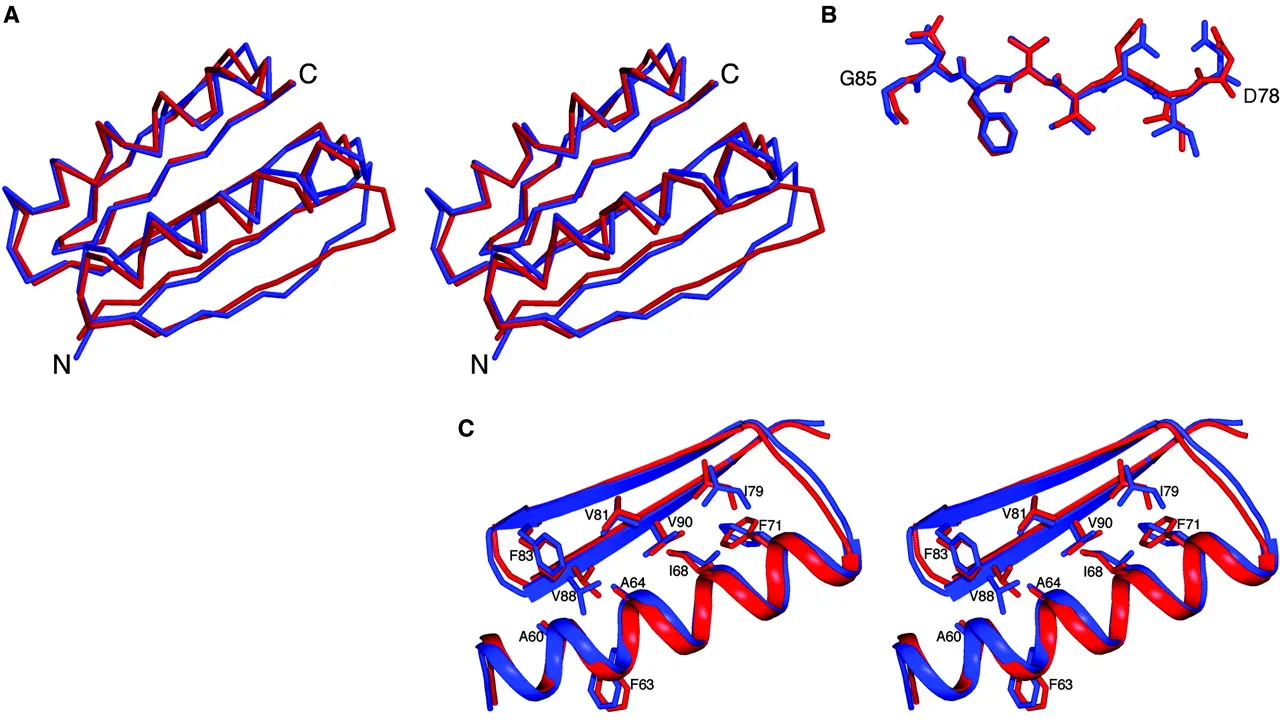
计算设计的模型(蓝色)与Top7的X射线解析结构(红色)的对比。来源
在 Baker 的工作之前,之前的研究所能做到的只是模仿或优化现有的结构,而不能从零开始设计新的结构。但 Top7 完全从头开始设计,不依赖于任何特定的序列。“如果你想造一架飞机,”Baker 说,“你会先了解空气动力学的基本原理,然后根据这些原理来设计并制造飞行器,而不是从修改一只鸟开始。”
蛋白质设计的将来自2003年以来,蛋白质设计方面取得了重大进展,这得益于对蛋白质结构和折叠原则更深入的理解、计算方法的改进和提高、可用计算资源的增加以及合成DNA的成本下降。
“我们一开始就知道有可能创造出一个全新的蛋白质世界来解决许多问题,”贝克在电话里宣布获奖时说道。
但是关于设计复杂的动态蛋白质,仍然有很多要学习的东西。例如,一个有趣的方面是,设计出的蛋白质往往比天然存在的蛋白质更稳定。一方面,这对设计蛋白质来说是一个稳健性的优点——它们非常擅长折叠并保持折叠状态。另一方面,自然选择在必要时是一个无情的优化者。这意味着稳定性降低可能是为了提高其他属性,如功能效率,而不得不付出的代价。结合位点、凹槽、催化位点和移动部件等,这些都是天然蛋白质功能丰富的特性,但它们会妥协理想的极端稳定性。在蛋白质周转很重要的情况下,较低的稳定性甚至可能是一个优点。能够设计具有多个低能状态的复杂蛋白质的计算工具将在多个领域得到广泛应用。
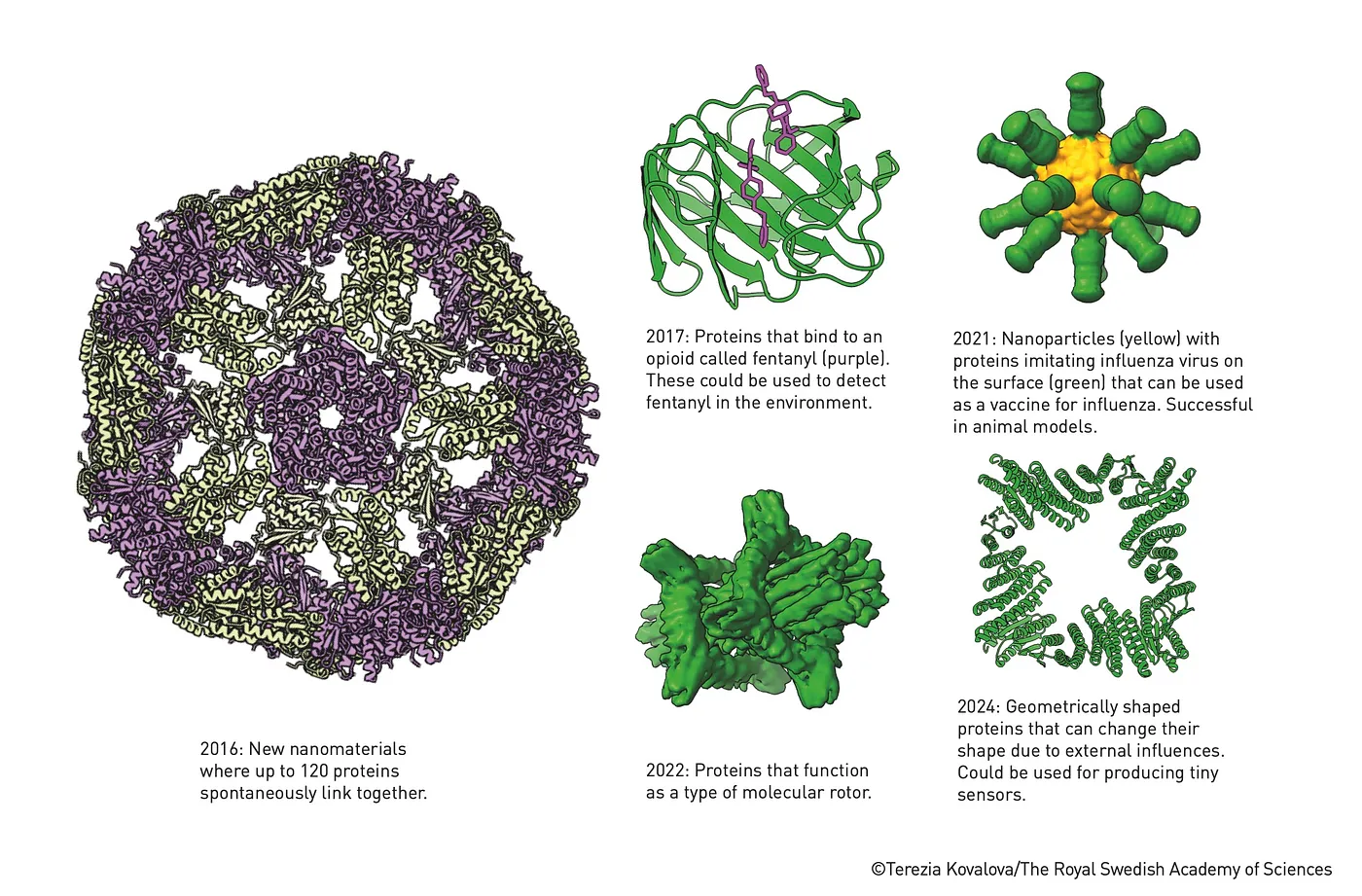
蛋白质是通过贝克(Baker)的程序Rosetta开发出来的。来源 (来源)
Baker的Rosetta程序继续被用来开发其他蛋白质,包括与芬太尼绑定的蛋白质,以及模仿流感病毒的蛋白质,以用于疫苗。因此,蛋白质设计的潜力广泛,包括新的纳米材料、靶向药物以及疫苗开发。
在授予Top7奖项时,皇家学院不仅在表彰首次从头设计蛋白质这一成就,同时也预示了定制蛋白质设计领域的光明前景。
参考资料-
Kuhlman B, Dantas G, Ireton GC, Varani G, Stoddard BL, Baker D. 设计了一种新的球状蛋白质折叠结构,精确到原子级。 Science. 2003年11月21日;302(5649):1364–8. doi: 10.1126/science.1089427. PMID: 14631033.
-
Baker D. 从头蛋白质设计向我们揭示了哪些关于蛋白质折叠和生物物理的知识? Protein Sci. 2019年4月;28(4):678–683. doi: 10.1002/pro.3588. PMID: 30746840; PMCID: PMC6423711.
- Huang PS, Boyken SE, Baker D. 从头设计蛋白质的成熟时代。 Nature. 2016年9月15日;537(7620):320–7. doi: 10.1038/nature19946. PMID: 27629638.

 随时随地看视频
随时随地看视频




